AbbVie presenta los últimos datos del estudio REFINE en pacientes con mielofibrosis no previamente tratados
El análisis exploratorio de la cohorte 3 del estudio fase 2 REFINE se ha presentado en una comunicación oral en ASH.
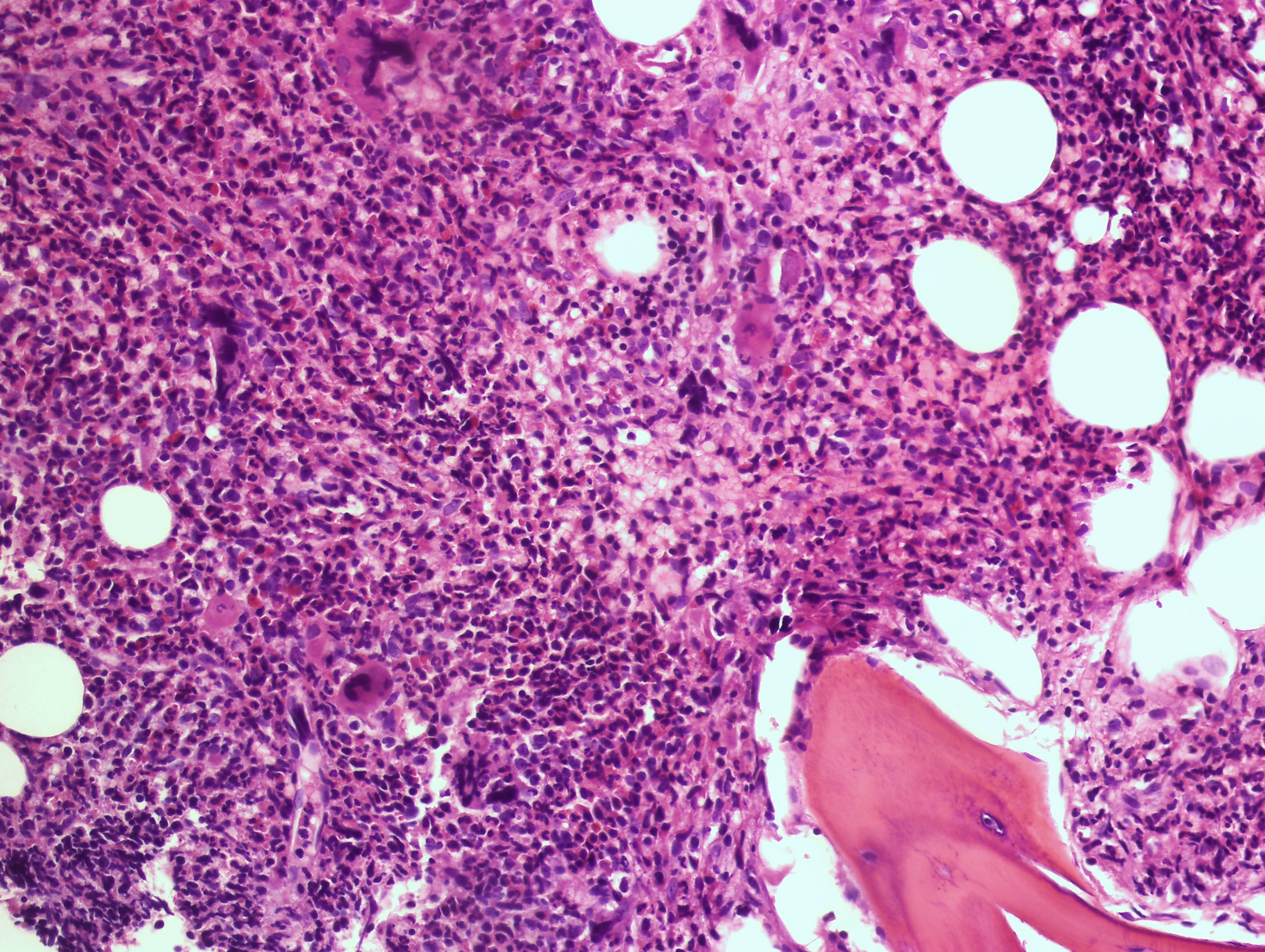
AbbVie ha presentado nuevos datos de la cohorte 3 del estudio fase 2 REFINE donde se estudió la molécula en investigación navitoclax en combinación con ruxolitinib en pacientes con mielofibrosis (MF) no tratados previamente con un inhibidor de Janus quinasas (JAK). El análisis exploratorio señala que la combinación de estas moléculas produjo disminuciones de la fibrosis de médula ósea (BMF) y la frecuencia de variantes alélicas (VAF) en mutaciones genéticas frecuentes identificadas en pacientes con mielofibrosis que pueden indicar una posible modificación de la enfermedad. Los resultados se dieron a conocer en una comunicación oral en la 64ª Reunión y Exposición Anual de la American Society of Hematology (ASH).
"Aunque el tratamiento de elección actual para los pacientes con mielofibrosis puede mejorar los síntomas de la enfermedad, el impacto en la biología de la enfermedad subyacente es limitado. Esperamos que los pacientes cuenten con una opción que vaya más allá del control de los síntomas", declaró el Dr. Mohamed Zaki, vicepresidente y director mundial de desarrollo clínico en oncología de AbbVie. "En consonancia con la evidencia previa, estos resultados sugieren que esta combinación podría modificar la enfermedad, tanto como agente antifibrótico como reduciendo la frecuencia de mutaciones iniciadoras en el alelo variante".
REFINE (NCT03222609) es un estudio fase 2, no aleatorizado, abierto de cohortes, para evaluar la seguridad y la eficacia de navitoclax solo o en combinación con ruxolitinib en los pacientes con mielofibrosis.
Estos datos se suman a los ya presentados por AbbVie, incluyendo las recientes presentaciones de los datos de este mismo estudio a principios de este año en el congreso anual de la American Association for Cancer Research (AACR) y el congreso anual de la European Hematology Association (EHA).
Los nuevos datos presentados en ASH están basados en un análisis exploratorio de 32 pacientes con MF no tratados previamente con inhibidores de JAK de la cohorte 3 del estudio fase 2 REFINE. El objetivo principal fue una reducción del volumen esplénico desde el inicio ≥ 35% (SVR35) en la semana 24. Los criterios de valoración secundarios y exploratorios clave evaluados en este análisis fueron la disminución de la BMF y la reducción de la VAF en relación con las mutaciones en genes oncoiniciadores (JAK2V617, CALR, MPL o triple negativo), respectivamente.
En este análisis exploratorio se observó una SVR35 en la semana 24 en los grupos de mayor riesgo, que mejoró con el tiempo. Los cuatro subgrupos de mal pronóstico fueron los siguientes: Tipo (primario o secundario) de MF (MF primaria, 59% [n = 10/17]; edad (≥ 75 años, 50% [n = 4/8]); puntuación de riesgo pronóstico, medida mediante el Dynamic International Prognostic Scoring System o DIPSS, por sus siglas en inglés (intermedio-2, 63% [n = 12/19]; alto, 33% [n = 1/3]); y presencia de mutaciones de alto riesgo molecular (ARM) (47 % [n = 9/19].
En la cohorte 3, la mejoría del grado de BMF fue evaluable en el 81% (26/32) de los pacientes. De estos participantes en el estudio, el 35% (9/26) experimento una mejoría de grado ≥ 1 en algún momento durante el tratamiento, con una mediana del tiempo hasta la mejoría de 12,3 semanas1. Se observó una resolución completa de la BMF en el 22% (2/9) de los pacientes.
Se observó una reducción de la VAF por mutación del gen oncoiniciador > 20% entre el inicio y las semanas 12 o 24 en el 50% (14/28) de los pacientes, mientras que el 18% (5/28) experimentó una disminución > 50% de la VAF con respecto al inicio. No hubo diferencias en las disminuciones de la VAF > 20% entre el inicio, y las semanas 12 o 24 entre los pacientes con o sin mutaciones ARM (47% [7/15] y 54% [7/13], respectivamente).
El análisis preliminar de la seguridad no identificó nuevas señales de seguridad. Veinticinco (78%) pacientes notificaron uno o más acontecimientos adversos (AA). Los AA de grado ≥ 3 más frecuentes fueron trombocitopenia (47%), anemia (34%) y neutropenia (25%). El 9,4% de los pacientes suspendió el tratamiento debido a un AA.
"Estos resultados son prometedores para los pacientes que necesitan una opción de tratamiento que vaya más allá del control de los síntomas", señaló Francesco Passamonti, catedrático de hematología de la Universidad de Insubria y jefe de hematología del Hospital Varese de Italia. "La sugerencia de modificación de la enfermedad en este análisis de este tratamiento en combinación es alentadora, sobre todo cuando se combina con eficacia clínica en cuanto a tasas de SVR35 en los grupos de mayor riesgo que mejoraron con el tiempo".










 &
& 
